Transporte por el xilema
Imágenes de cómo probar la capacidad de las plantas para transportar agua a través del xilema.
http://pagingfunmums.com/2013/07/09/fun-science-experiment-learning-how-plants-absorb-water/

Virtual Labs: laboratorios virtuales.
Muy interesantes simulaciones de prácticas.
Lo único malo es que están diseñados en flash ;-(
Extracción de ADN
OBJETIVOS:
- Utilizar unas sencillas técnicas para poder extraer el ADN de un producto natural
- Observar la estructura fibrilar del ADN.
MATERIAL
Tubos de ensayo, un cuchillo, palitos de pinchos, una batidora. Papel de filtro o filtro de café. Cebolla grande fresca, agua destilada. Detergente lavavajillas, sal, zumo de piña o de papaya, alcohol de 96º muy frío.
Realización de la práctica.
- Cortamos la zona central de la cebolla en dados
- En un vaso de agua echamos 3 cucharaditas de detergente lavavajillas y una de sal y añadimos agua destilada hasta llenar el vaso.
- Mezclamos esta solución con los trozos de cebolla
- Licúamos el conjunto, con la batidora, a velocidad máxima durante 30 segundos
- Filtramos el líquido obtenido con un filtro de café.
- Llenamos un cuarto de un tubo de ensayo con la disolución filtrada.
- Añade otro tanto de zumo de piña y mezclamos bien.
- Añadimos un volumen de alcohol muy frío equivalente al del filtrado, cuidadosamente, haciéndolo resbalar por las paredes del vaso para que forme una capa sobre el filtrado.
- Dejamos reposar durante 2 ó 3 minutos hasta que se forme una zona turbia entre las dos capas. A continuación introducimos la varilla y movemos adelante y atrás.
- Extraemos una maraña de fibras blancas de ADN.
PRECAUCIÓN:Cuando añadas el alcohol frío debes hacerlo de forma que resbale por las paredes del tubo para que forme una capa sobre el filtrado. Puedes utilizar la varilla de vidrio o una cucharilla para ayudarte.También puedes hacerlo con una pipeta Pasteur.
Fundamento de la práctica.
La extracción de ADN requiere una serie de etapas básicas. En primer lugar tienen que romperse la pared celular y la membrana plasmática para poder acceder al núcleo de la célula. A continuación debe romperse también la membrana nuclear para dejar libre el ADN. Por último hay que proteger el ADN de enzimas que puedan degradarlo y para aislarlo hay que hacer que precipite en alcohol. La solución de lavavajillas y sal ayudada por la acción de la licuadora es capaz de romper la pared celular y las membranas plasmática y nuclear.Los zumos de piña y papaya contienen un enzima, la papaína, que contribuye a eliminar las proteínas que puedan contaminar el ADN. El alcohol se utiliza para precipitar el ADN que es soluble en agua pero, cuando se encuentra en alcohol se desenrolla y precipita en la interfase entre el alcohol y el agua.
Preparación de diversos colorantes.
- Acido-Alcohol: (decolorante para tinción Ziehl-Neelsen)
- Ácido clorhídrico concentrado ………………………………………………….3 ml
- Etanol 95% …………………………………………………………………………97 ml
- Azul de metileno: Colorante de contraste para tinción de flagelos.
- Azul de metileno……………………………………………………………………..1 g
- Agua destilada…………………………………………………………………….100 ml
- Azul de metileno de Loeffler: Tinciones simples.
- Solución de hidróxido potásico al 1%………………………………………….1 ml
- Azul de metileno, sol. saturada en etanol al 95%………………………….30 ml
- Agua destilada…………………………………………………………………….100 ml
- Colorante para esporas:
- Solución acuosa saturada de verde malaquita
- Colorante para flagelos de Leifson:
- Solución A
- Fucsina básica ……………………………………………………………….1,2 g
- Etanol 95%…………………………………………………………………..100 ml
- Solución B
- Ácido tánico……………………………………………………………………..3 g
- Agua destilada……………………………………………………………….100 ml
- Solución C
- Cloruro sódico………………………………………………………………..1,5 g
- Agua destilada……………………………………………………………….100 ml
Para preparar la solución de uso, se mezclan cantidades iguales de las soluciones A, B y C y se guarda en frasco cerrado herméticamente en la nevera donde es estable durante varias semanas.
- Solución A
- Cristal violeta: Para tinción Gram y tinción simple.
- Cristal violeta (violeta de genciana)…………………………………………….0,5 g
- Agua destilada………………………………………………………………………100 ml
- Eosina: Para observación de células sanguíneas.
- Eosina…………………………………………………………………………………..0,3 g
- Ácido acético glacial…………………………………………………………….0,025 ml
- Agua destilada………………………………………………………………………..100 ml
- Fucsina diluida: Para tinción Gram y tinción simple.
- Fucsina fenicada de Ziehl-Neelsen………………………………………………10 ml
- Agua destilada………………………………………………………………………100 ml
- Fucsina fenicada de Ziehl-Neelsen: Para tinción ácido-alcohol resistente.
- Fucsina básica…………………………………………………………………………..1 g
- Etanol 95%…………………………………………………………………………….10 ml
- Fenol 5% en solución acuosa……………………………………………………100 ml
- Hematoxilina: Para observación de células sanguíneas.
- Hematoxilina……………………………………………………………………………..2 g
- Agua destilada…………………………………………………………………………..1 l
- Lactofenol: Para preparaciones microscópicas en fresco de mohos.
- Ácido láctico………………………………………………………………………….100 ml
- Fenol……………………………………………………………………………………100 g
- Glicerol…………………………………………………………………………………200 ml
- Agua…………………………………………………………………………………….100 ml
- Lactofenol al Azul Algodón: Para preparaciones en fresco y tinciones de mohos.
- Solución de azul algodón
- Sol. saturada de azul algodón (azul anilina soluble)………………….10 ml
- Glicerol………………………………………………………………………….10 ml
- Agua……………………………………………………………………………..80 ml
Mezclar esta solución con lactofenol a partes iguales
- Solución de azul algodón
- Lugol: Solución de yodo para tinción Gram.
- Yodo………………………………………………………………………………………1 g
- Yoduro potásico……………………………………………………………………….2 g
- Agua destilada………………………………………………………………………300 ml
- Orceína A: Tinción de cromosomas.
- Orceína……………………………………………………………………………………2 g
- Ácido acético………………………………………………………………………….45,8 ml
- Ácido clorhídrico 1 mol/l…………………………………………………………….8,3 ml
- Agua……………………………………………………………………………………..45,8 ml
- Orceína B: Tinción de cromosomas.
- Orceína……………………………………………………………………………………2 g
- Ácido acético………………………………………………………………………….55 ml
- Agua……………………………………………………………………………………..55 ml
- Safranina: Colorante de contraste para tinción Gram (preferible a la fucsina) y esporas.
- Safranina……………………………………………………………………………..0,25 g
- Agua destilada……………………………………………………………………….100 m
- Sudán III: Tinción específica de grasas.
- Alcohol etílico………………………………………………………………………..100 ml
- Sudán III………………………………………………………………………..hasta saturación
- Verde de metilo acético: Igual composición que la eosina (num. 7)
Tomado de RECURSOS DIDACTICOS PARA BIOLOGÍA.
Construcción de un modelo en papel del ADN
Seguir las indicaciones de la página DNA Models (en inglés).
¡Eso es todo! 😉
OBJETIVOS
- Observar al microscopio y reconocer algunos orgánulos vegetales: cloroplastos, cromoplastos y amiloplastos.
MATERIALES
- Microscopio óptico, portaobjetos, cubreobjetos, soporte para tinciones, cuchilla o bisturí, lugol.
- Material biológico: patata, semillas de legumbres,tomates maduros, algas filamentosas.
CONCEPTOS TEÓRICOS A RECORDAR.
Los vegetales son seres autótrofos fotosintéticos. Gracias a la clorofila son capaces de sintetizar materia orgánica, fundamentalmente glúcidos, a partir de compuestos inorgánicos como el CO2. Los plastos son los principales orgánulos implicados en dicho proceso.
El almidón, es un producto de reserva, que se acumula en ciertas partes de la planta, sobre todo en las raíces, tubérculos y semillas y que está destinado a sustentar a la planta.
Podemos extraerlo facílmente de la patata. En esta se va acumulando en los plastos, en capas concéntricas.
PROCEDIMIENTO.
CLOROPLASTOS.
- Colocar sobre el portaobjetos un filamento del alga bien extendido.
- Añadir una gota de agua y poner el cubreobjetos.
- Observar al microscopio a distintos aumentos.
CROMOPLASTOS.
- Cortar o raspar con un escalpelo , finísimas porciones de pulpa de tomate maduro de la zona situada bajo el epicarpio (piel).
- Depositar la muesta más fina que se haya obtenido sobre un portaobjetos, colocar encima el cubreobjetos y comprimir suavemente y lentamente.
- Observar al microscopio.
AMILOPLASTOS.
- Partir una patata y raspar con la punta del bisturí, depositando el producto obtenido en un porta-objeto.
- Dejar secar completamente y teñir con unas gotas de lugol o yodo. Dejar actuar dos minutos.
- Poner el cubre-objeto y observar al microscopio. Con poco aumento buscar la zona de la preparación en la que los granos estén menos aglutinados, localizada ésta, cambiar a aumentos mayores. Observar cerrando el diafragma lo máximo permitido por el foco luminoso.
- Puede rasparse también distintas semillas (judía, guisante, habichuela, maiz, etc), realizando el proceso similar al del raspado de la patata. Es conveniente para poder ver el aspecto distinto de amiloplastos en distintas plantas.
ANÁLISIS Y CONCLUSIONES.
- Realizar un informe en el que se incluyan dibujos de cada uno de los tipos de plastos, analizando las diferencias de los mismos y el posible motivo de las mismas.
- Contestar a las siguientes preguntas:
- ¿Cuál es el pigmento que contienen los cloroplastos?¿Qué función tienen?
- ¿Qué color presentan los cromoplastos observados? ¿Qué función tienen los cromoplastos?
- ¿Qué función tienen los amiloplastos?
- ¿Qué es la epidermis de una hoja y qué finalidad tiene? ¿Porqué encontramos en ella plastos?
- ¿Has podido ver algún otro orgánulo celular? ¿Cuáles?
Estudio de los fenómenos osmóticos
OBJETIVOS
1. Observar al microscopio los efectos que tiene en la célula la existencia de distintas concentraciones en el medio extracelular y en el citoplasma.
2. Comprender los conceptos de plasmolisis y turgescencia.
MATERIALES
1. Placas de petri, tijeras, pinzas, microscopio óptico, portaobjetos, cubreobjetos, agua destilada o desionizada, disoluciones de cloruro de sodio de diversas concentraciones.
2. Material biológico: Cebolla.
CONCEPTOS TEÓRICOS A RECORDAR.
Ósmosis, presión osmótica, plasmolisis, turgencia.
PROCEDIMIENTO.
Antes de realizar el experimento, hay que preparar en sendos vasos de precipitados cuatro disoluciones de cloruro de sodio con diferentes concentraciones (4 g/L, 8 g/L, 12 g/L y 16 g/L), utilizando para ello agua destilada o desionizada. Deberás anotar en cada vaso la concentración correspondiente.
- Pon 10 ml de agua destilada y de cada una de las disoluciones anteriores en sendas placas de petri,numeradas para poder identificarlas.
- Corta con las tijeras cinco trozos pequeños de la epidermis que tapiza el interior de las capas externas de la cebolla.
- Coloca un trozo de epidermis en cada uno de las placas de petri y manténlos sumergidos durante 10 minutos.
- Pasado ese tiempo, extrae los trocitos de epidermis con ayuda de las pinzas y obsérvalos directamente al microscopio.
ANÁLISIS Y CONCLUSIONES.
- Con lentes de poco aumento, observa al microscopio el aspecto de las células de la epidermis que han estado sumergidas en las distintas disoluciones salinas.
- Dibuja una célula que haya sufrido turgencia y otra que haya sufrido plasmolisis.
- Cuenta en cada caso el número de células que presentan señales de haber sufrido turgencia o plasmolisis (de un total aproximado de 25 células observadas). Halla el % en cada caso.
• Rellena la siguiente tabla con los datos recogidos:

Con los resultados anteriores, representa sobre papel milimetrado sendas gráficas que representen % de turgencia o plasmolisis, en función de la concentración salina.
Responde a las siguientes preguntas:
- ¿Por qué no se pueden preparar las disoluciones de cloruro de sodio con agua del grifo?
- ¿A qué se deben los fenómenos observados?
- ¿Qué puedes decir sobre la concentración osmótica del citoplasma de las células de la epidermis de cebolla?
- ¿Se habrían obtenido los mismos resultados si se hubiera empleado un alga marina en el experimento?
MATERIAL
1. Microscopio, pocillos de tinciones, agua destilada, portaobjetos (2), alcohol de 96°, solución de May Grünwald, solución de Giemsa, sangre de mamífero (humana, de cordero, de cerdo, etc.), citrato sódico al 10% (opcional).
Existen diferentes técnicas para fijar y teñir los componentes de la sangre, como la técnica de tinción doble de May Grünwald-Glemsa. La solución de May Grünwald se utiliza directamente en su forma comercial. La solución de Giemsa se prepara diluida en la proporción de una gota de Giemsa por cada cm3 de agua destilada. Este método tiñe de diversos colores y matices las distintas estructuras celulares de la sangre y permite identificarlas.
1. EXTENSIÓN DEL FROTIS
Deposita una gota de sangre cerca del extremo de un portaobjetos. Apoya el extremo de otro portaobjetos (si es posible, más estrecho y con el borde esmerilado) sobre la gota hasta que esta se extienda por capilaridad.
Extiéndela, como se aprecia en la imagen, de una pasada rápida para que resulte una sola capa de células. El ángulo de los portaobjetos no debe ser mayor de 45°, pues cuanto mayor sea y más lenta se haga la extensión, la capa resultará más gruesa. El frotis debe secarse rápidamente al aire para evitar la formación de pequeños coágulos, lo que se facilita moviendo el portaobjetos en forma de abanico (nunca a la llama).
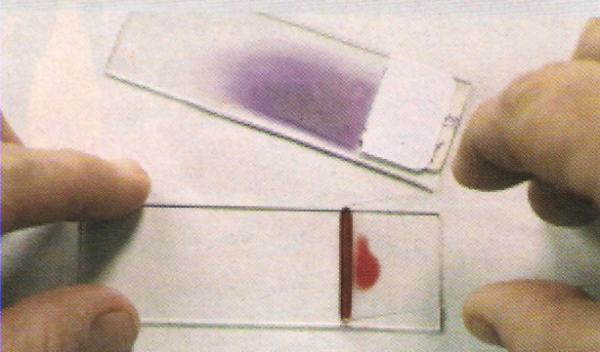
2. TINCIÓN DEL FROTIS
- Una vez colocado el frotis sobre el pocillo de tinciones, se cubre con un número determinado de gotas (hay que contarlas) de la solución de May Grünwald y se deja actuar durante 3 minutos.
- Sin quitar la solución anterior, se depositan sobre ella el mismo número de gotas de agua destilada, procurando mezclar ambos líquidos, y se deja otros 5 minutos.
- Se retira ahora el colorante escurriéndolo con cuidado sobre el pocillo, pero sin lavar. Se vuelve a cubrir la extensión con la solución de Giemsa diluida, Se deja actuar entre 25 y 30 minutos. Mientras tanto, si hay frotis ya preparados en el laboratorio (de sangre humana u otros vertebrados), puedes observarlos para comparar.
- Lava la preparación dejando caer un hilo de agua corriente sobre el extremo de la preparación y sécala al aire.
3. OBSERVACIÓN MICROSCÓPICA
Con el objetivo de menor aumento se localiza una zona del frotis en la que las células no se encuentren aglomeradas y no haya precipitaciones de colorante. Resultará interesante observar los bordes de la extensión dejados al arrastrar, pues en ellos abundan distintos tipos de leucocitos. Se pasa a mayor aumento para observar predominantemente eritrocitos y leucocitos, mucho menos abundantes, que destacan por quedar teñidos en tonos azul-violeta.
4. ANÁLISIS E INTERPRETACIÓN DE LOS RESULTADOS
Identifica los distintos tipos celulares y redacta un pequeño informe destacando las características de cada uno de ellos.
NO OLVIDES AL TERMINAR LA PRÁCTICA RECOGER Y LIMPIAR TODO EL MATERIAL UTILIZADO.
MATERIAL
1. Microscopio, frasco lavador, vidrios de reloj, portaobjetos y cubreobjetos, aguja enmangada, pinzas, pocillo para tinciones, safranina, pera.
1. PROCEDIMIENTO.
Raspa un poco de la parte carnosa de la pera sobre el portaobjetos. Extiéndela bien con la aguja o aplástala con otro porta. Deposita unas gotas de safranina y deja teñir durante 5 minutos. Retira el colorante, pon una gota de agua y monta el cubre.
2. ANÁLISIS E INTERPRETACIÓN DE LOS RESULTADOS
Observa las células del parénquima de rojo pálido y unas aglomeraciones celulares de color rojo intenso que corresponden a células de esclerénquima o células pétreas (parecen piedrecillas al masticarlas).
NO OLVIDES AL TERMINAR LA PRÁCTICA RECOGER Y LIMPIAR TODO EL MATERIAL UTILIZADO.
Observación de tejidos vegetales: parénquima de reserva o asimilador de la patata y súber
MATERIAL
1. Microscopio, frasco lavador, vidrios de reloj, portaobjetos y cubreobjetos, aguja enmangada, pinzas, pocillo para tinciones, lugol, patata.
1. PROCEDIMIENTO.
- Realiza cortes finísimos, perpendiculares a la superficie, que contengan piel (súber) y algo del Interior blanco (parénquima de reserva).
- Pon varias muestras sobre un par de gotas de Lugol en el portaobjetos durante 2 minutos. Retira el colorante, coloca una gota de agua o glicerina y pon el cubreobjetos.
2. ANÁLISIS E INTERPRETACIÓN DE LOS RESULTADOS
Observa la diferencia entre las células del súber y del parénquima. Describe y dibuja. A grandes aumentos observa y dibuja los granos de almidón teñidos de violeta.
NO OLVIDES AL TERMINAR LA PRÁCTICA RECOGER Y LIMPIAR TODO EL MATERIAL UTILIZADO.